波爾理論
波爾理論是由丹麥物理學(xué)家尼爾斯·玻爾在1913年提出的,它是為了解決核式結(jié)構(gòu)模型所遇到的困難,特別是原子穩(wěn)定性的問題。波爾理論的基礎(chǔ)是普朗克的量子論和愛因斯坦的光子學(xué)說,它引入了量子化概念,提出了原子結(jié)構(gòu)的一系列假設(shè),成功解釋了氫原子光譜的現(xiàn)象。以下是波爾理論的主要內(nèi)容:
1. 定態(tài)假設(shè):原子只能處在一系列不連續(xù)的能量狀態(tài)中,在這些狀態(tài)中原子是穩(wěn)定的,電子繞原子核旋轉(zhuǎn),但并不向外輻射電磁波。這些狀態(tài)被稱為定態(tài) 。
2. 量子化軌道:原子的能量狀態(tài)與電子繞核運動的軌道對應(yīng)。電子的動量與軌道半徑滿足特定的量子化關(guān)系,即\[mvr = n\frac{h}{2\pi}\],其中\(zhòng)(n\)是量子數(shù),\(h\)是普朗克常量 。
3. 躍遷與光譜:當(dāng)原子中的電子從一個軌道躍遷到另一個軌道時,會發(fā)射或吸收特定頻率的電磁波。電磁波的能量由\[h\nu = |E_n - E_m|\]給出,其中\(zhòng)(\nu\)是電磁波的頻率,\(E_n\)和\(E_m\)分別是電子在兩個不同軌道上的能量 。
波爾理論成功地解釋了氫原子的光譜現(xiàn)象,特別是巴爾末系譜線的波長分布。它在解釋更復(fù)雜原子的光譜時遇到了困難,因為它仍然保留了經(jīng)典概念,沒有完全跳出經(jīng)典力學(xué)的范圍 。盡管如此,波爾理論在原子物理學(xué)的發(fā)展中起到了承前啟后的作用,為量子力學(xué)的發(fā)展奠定了基礎(chǔ)。
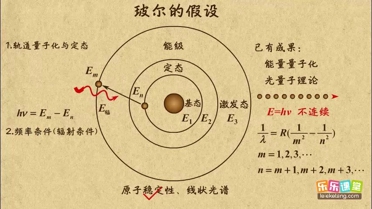
玻爾理論公式
玻爾理論是由丹麥物理學(xué)家尼爾斯·玻爾在1913年提出的,用以解釋氫原子的光譜線。玻爾理論主要包括以下幾個基本假設(shè):
1. 量子化軌道:電子只能在特定的軌道上繞原子核運動,這些軌道是量子化的,即電子的角動量是 \( \hbar \)(約化普朗克常數(shù))的整數(shù)倍,用 \( n \) 表示,即 \( L = n\hbar \)。
2. 定態(tài)假設(shè):當(dāng)電子在這些特定的軌道上運動時,原子不發(fā)射也不吸收能量,這些狀態(tài)被稱為定態(tài)。
3. 頻率條件:當(dāng)電子從一個軌道躍遷到另一個軌道時,會伴隨著能量的發(fā)射或吸收。發(fā)射或吸收的光子的能量等于兩個軌道之間能量差,并且滿足頻率條件 \( E_m - E_n = h\nu \),其中 \( h \) 是普朗克常數(shù),\( \nu \) 是光的頻率。
4. 玻爾模型的能級公式:玻爾模型中,氫原子的能級 \( E \) 可以用以下公式表示:
\[ E_n = -\frac{m e^4}{2\hbar^2} \frac{1}{n^2} \]
其中,\( m \) 是電子質(zhì)量,\( e \) 是電子電荷,\( \hbar \) 是約化普朗克常數(shù),\( n \) 是主量子數(shù)。
5. 玻爾半徑:氫原子基態(tài)(\( n = 1 \))的軌道半徑 \( a_0 \) 被稱為玻爾半徑,可以用以下公式表示:
\[ a_0 = \frac{\hbar^2}{m e^2} \]
這些公式和假設(shè)構(gòu)成了玻爾模型的基礎(chǔ),雖然它在解釋更復(fù)雜的原子和分子的光譜時存在局限性,但對于氫原子的光譜和量子力學(xué)的早期發(fā)展具有重要意義。
玻爾氫原子理論三個內(nèi)容
尼爾斯·玻爾提出的氫原子理論是量子力學(xué)發(fā)展中的一個重要里程碑,其主要內(nèi)容包括:
1. 量子化軌道:電子在原子中只能沿著特定的軌道運動,這些軌道是量子化的,即它們具有特定的能量值。電子不能在這些軌道之間隨意移動,也不能存在于軌道之間的空間。
2. 能量的量子躍遷:電子在不同的量子化軌道之間躍遷時,會吸收或釋放特定量的能量。這個能量差與電子躍遷前后所在軌道的能量有關(guān),并且是量子化的,即只能以特定值出現(xiàn)。
3. 輻射條件:當(dāng)電子從一個高能級軌道躍遷到一個低能級軌道時,會以光子的形式釋放能量;相反,當(dāng)電子從一個低能級軌道吸收能量躍遷到高能級軌道時,會吸收特定頻率的光子。這些光子的能量等于電子躍遷前后軌道能量的差值。
玻爾的氫原子理論成功地解釋了氫原子光譜的發(fā)射線,并且為后來的量子力學(xué)發(fā)展奠定了基礎(chǔ)。它也有局限性,比如不能很好地解釋更復(fù)雜的原子和分子的光譜,這些問題后來通過量子力學(xué)的進一步發(fā)展得到了解決。

 微信掃一掃打賞
微信掃一掃打賞